中国药包材监管标准及模式
2018-03-09 10:00:29
《中国药典》作为国家药品标准体系的重要组成部分,连同颁布的《中华人民共和国药品管理法》,《中华人民共和国药品管理法实施条例》,《药包材登记资料要求》以及各类技术指导原则通告为指导,加上国家药包材标准(简称YBB标准)共同组成了药包材监管的法规体系。根据国家药品监督管理局公告(2019年第56号公告)内容,中国对药包材的监管由以往的注册管理制度变为登记制度,并与药品制剂或原料药进行关联技术审评,使得审批审评更为高效和科学。
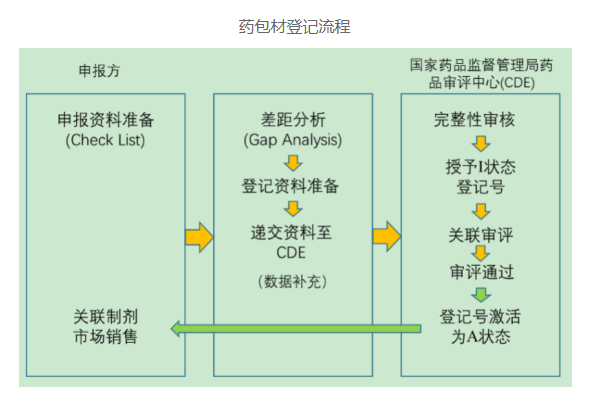
药包材登记步骤
· 在CDE门户网站填写药包材的基本信息,并将登记资料以光盘形式提交至CDE;
· CDE在收到资料后5个工作日内,对登记资料进行完整性审查;
· 当资料不齐全时,需要药包材企业对登记资料进行补充直至符合要求。CDE会对相关登记信息进行公示,并授予I状态登记号(登记号组成:B+四位年号+七位流水号);
· 当药包材通过关联审评后,登记号激活为A状态。
药包材登记资料
《国家药监局关于进一步完善药品关联审评审批和监管工作有关事宜的公告(2019年 第56号)》根据使用情况对药包材的分为以下类别:
· 未在境内外上市药品中使用过的药包材(如新材料、新结构);
· 已在境内外上市药品中使用过,但改变药品给药途径且风险提高的药包材;
· 未在境内外上市药品中使用过,但是可证明在食品包装中使用过的与食品直接接触的药包材(仅限用于口服制剂);
· 已在相同给药途径的上市药品中使用过的药包材;
· 其他
我们的服务
· 药包材登记咨询
· 药包材登记业务代理
· 登记备案资料翻译
· 药包材关联评审跟进
· 药包材年度报告
· 实验室委托及测试监理
· 官方问询沟通